




团队负责人:
中国科学技术大学特任研究员
入选中科院人才计划
团队成员:
沈炳鑫(硕士研究生)、曹梓贤(硕士研究生)、黄燕侃(硕士研究生)
主要研究内容:
活体光学显微成像旨在无创地观察活体组织或模式动物体内的(亚)细胞结构并跟踪其功能动态,在生命科学和临床诊疗两方面都有广泛的应用。相比于离体的组织切片或贴壁培养的细胞等薄样本,对活体组织的成像有两大特点,同时也是技术挑战:一是需要三维分辨(也称深度层析)能力以直接探查厚样本,二是需要具备足够的三维时空分辨率来捕捉活体的动态功能信息。
随着新型钙离子敏感荧光蛋白和能分辨单个动作电位的电压敏感分子荧光探针的发展,神经科学界亟需具备更高时空分辨率的新型三维活体显微成像技术。如何创新成像原理和采集策略,不断提升时空分辨率、视场范围、成像深度等核心性能指标,是本课题组未来的战略方向之一。
另一方面,在诸如无创(早期)诊断、活检辅助、精微手术导航、治疗随访等临床诊疗场景中,成像装置的小型化、微型化至关重要。如何通过架构设计和核心元器件等方面的突破,创制出能实时、无创、原位在体地获取表皮下组织的三维微观病理学结构和功能信息的手持式或内窥式小型(微型)显微探头,达到“无需切片、胜似切片”的成像效果,是本课题组另一个战略方向。
学生培养:
课题组的总体培养理念是助力每一位同学成长为更好的自己,具体有两大原则:
个性化选题:课题组依托苏州生物医学工程与本部医学物理两大学科,开展理工生医交叉研究并鼓励学生原创。将根据不同的背景、特长与兴趣,为学生量身打造学位论文课题。
多元化培养:在培养发散创新思维与严谨科研态度的同时,重视演讲与表达能力、团队精神、组织领导能力等的培养,支持其他有助于个人职业规划的实习与培训机会。
此外,作为新入职的博导,梁老师将在未来N年践行“超级博士后”的工作模式,身体力行直接参与系统设计、样机开发、动物实验和数据分析等一线科研工作。现在加入实验室的你,将有机会与导师和实验室一起成长、共同进步。有兴趣的同学请将简历等相关材料发送至:liangwenxuan@ustc.edu.cn,课题组期待你的加盟!!!
近期学术成果:
1. 主导研发了两代基于柔性光纤扫描的微型双光子显微内窥成像技术
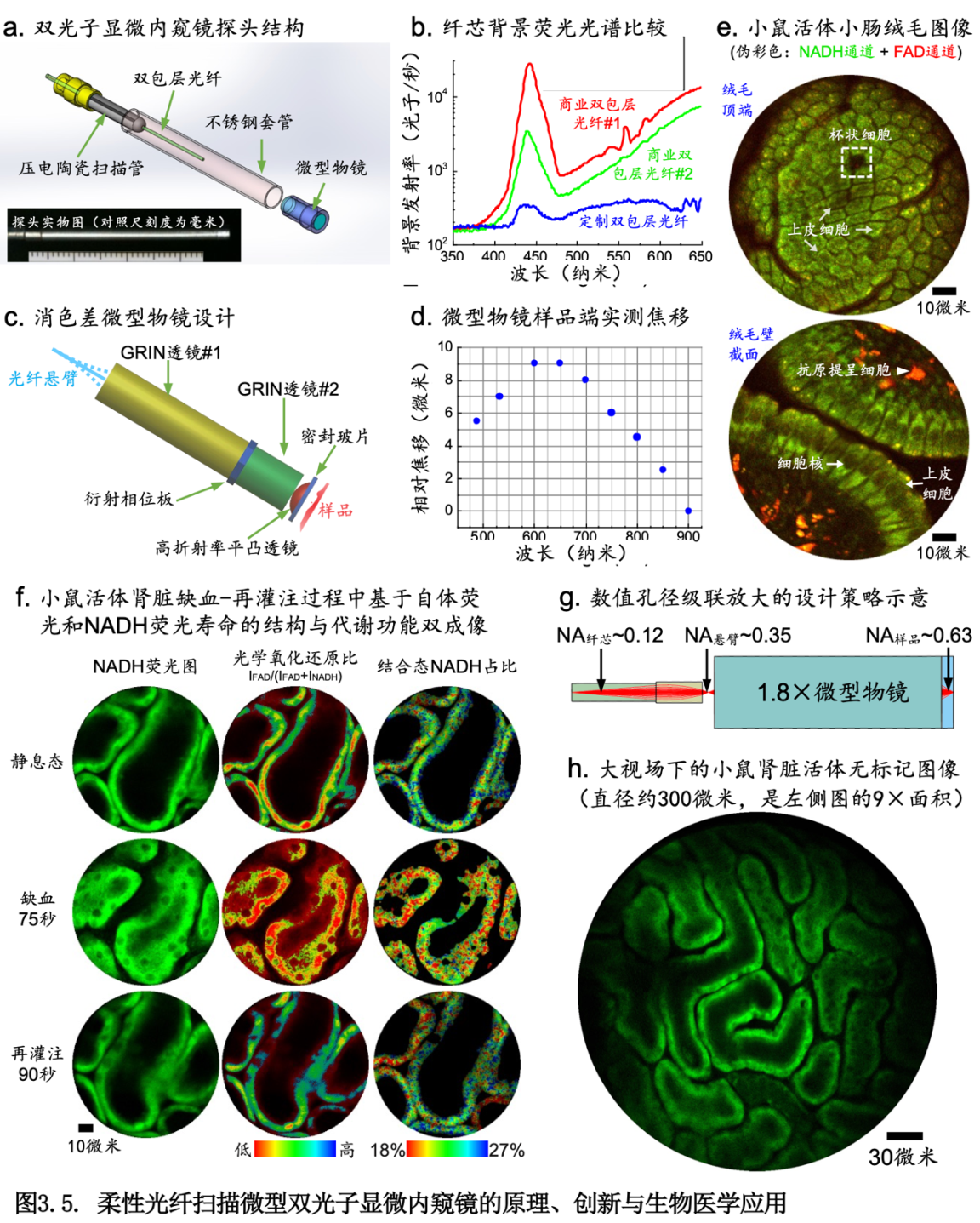
(a) 在一根直径仅约2毫米、重量不足1克的成像探头内集成了双光子荧光激发、扫描和荧光收集等全部功能,并通过一系列物理原理和技术创新,突破了多项技术瓶颈,将探测灵敏度比前代技术大幅提升了20-50倍,取得了国际领先的综合成像性能指标,实现了可实用的、仅靠内源性双光子荧光的活体动态结构与功能成像,能清晰分辨小肠、肝脏、肾脏等器官内上皮和皮下组织的亚细胞结构。
(b) 在双光子显微内窥镜系统中集成了光学氧化还原比和NADH荧光寿命成像两种功能成像模式,在活体动物模型上展示了基于线粒体自发荧光的全内窥式动态双光子结构与代谢功能双重成像。实验数据表明,该系统能够跟踪活体小鼠肾小管上皮细胞在缺血-再灌注过程中氧化还原比的动态变化和胞内NADH在游离态与结合态之间的转换,也能检测和跟踪小鼠皮下移植肿瘤在诱导凋亡过程中癌细胞内游离态和结合态两种NADH的浓度与荧光寿命的变化。如此叠加了定量代谢功能信息的、具有微米级别分辨率的精细结构图像在临床诊疗中有广阔的应用前景。
(c) 开创了数值孔径级联放大的设计策略,将光纤扫描显微内镜的视场-数值孔径-帧率三重积提升了至少3倍,成功研制了比前一代视场扩大了9倍或者帧率提高了3倍的新型探头,可以更灵活的适应不同的应用场景;该设计策略广泛适用于各种光纤扫描成像架构。
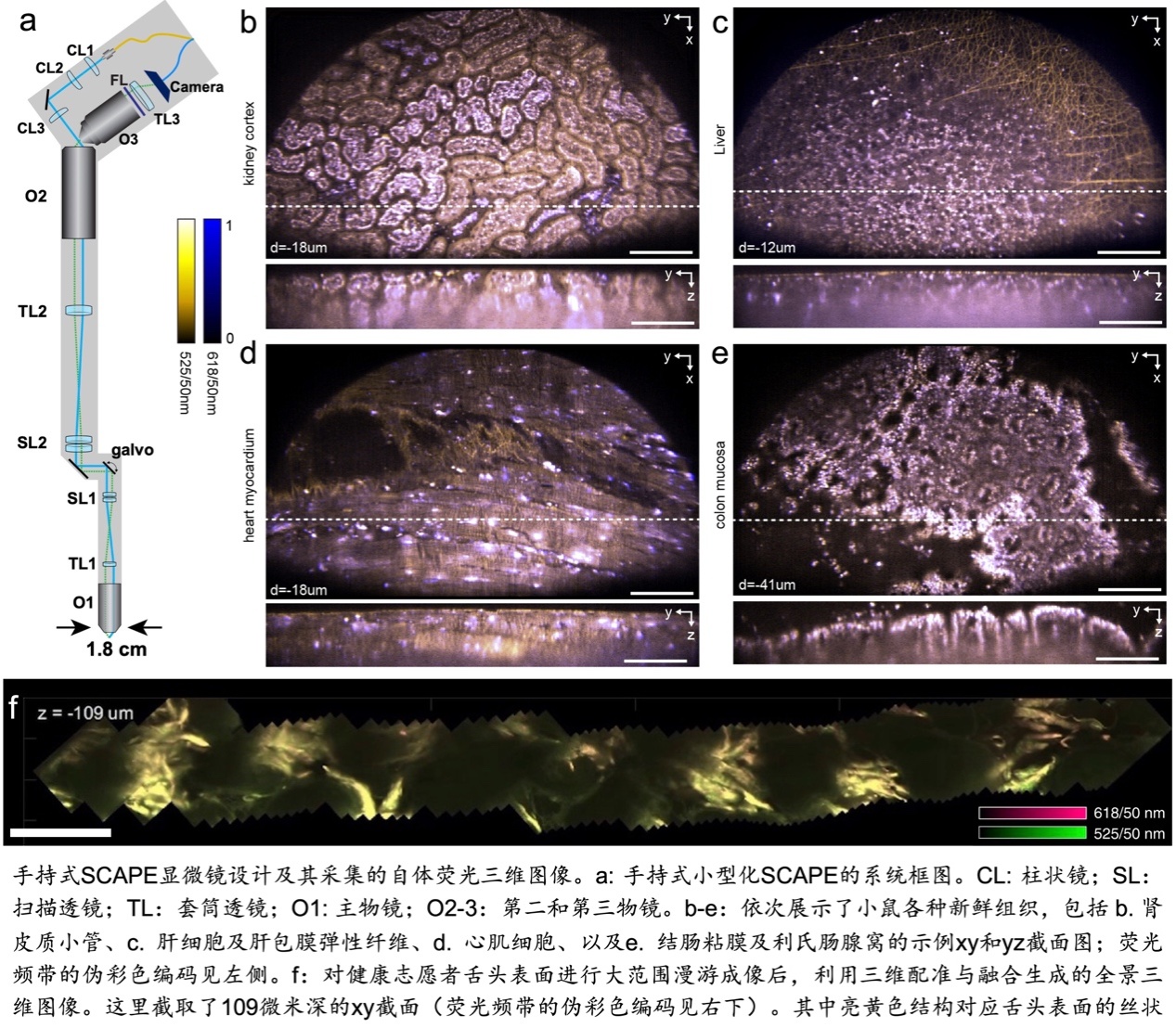
2. 主导(或联合主导)开发了若干款新型共焦斜照(swept confocally-aligned planar excitation; SCAPE)三维显微体成像系统,特别是设计开发了首台用于临床实时在体荧光体成像的小型化共焦斜照显微镜样机,在整机台面面积缩至标准台式系统的20%的同时保证了同等水平的信号强度和三维分辨率,实现了仅依靠内源性自体荧光的无标记高速三维体成像。医生可以操控该探头在待探查组织的表面快速游走,其高速三维体帧率保证了即使存在由呼吸或其他因素导致的活体组织与探头之间的轴向相对运动,所采集的相邻两组体数据之间也有足够的空间重叠,从而支持后期通过三维配准和图像融合算法“去抖动”,实现“漫游式”全景扫描三维体成像。
论文:
1. Liang W†, Liu Y, Guan H, Sakulsaengprapha V, Luby-Phelps K, Mahendroo M, and Li X. Cervical Collagen Network Porosity Assessed by SHG Endomicroscopy Distinguishes Preterm and Normal Pregnancy — a Pilot Study. IEEE Transactions on Biomedical Engineering (Accepted) DOI: 10.1109/TBME.2024.3472015. †Correspondence
2. Hall G*, Liang W*†, Bhujwalla ZM, and Li X. SHG fiberscopy assessment of collagen morphology and its potential for breast cancer optical histology. IEEE Transactions on Biomedical Engineering 71(8), 2414-2420 (2024). *Equal contribution, †Correspondence
3. Liang W, Chen D, Guan H, Park HC, Li K, Li A, Li MJ and Li X. Label-Free metabolic imaging in vivo by two-photon fluorescence lifetime endomicroscopy. ACS Photonics (2022) https://doi.org/10.1021/acsphotonics.2c01493
4. Patel KB, Liang W, Casper MJ, Voleti V, Zhao HT, Perez-Campos C, Liu JM, Coley SM, and Hillman EMC. High-speed light-sheet microscopy for the in-situ acquisition of volumetric histological images of living tissue. Nature Biomedical Engineering 6, 569-583 (2022) https://doi.org/10.1038/s41551-022-00849-7
5. Liang W, Park HC, Li K, Li A, Chen D, Guan H, Yue Y, Gau YT, Bergles DE, Li MJ, Lu H, and Li X. Throughput-speed product augmentation for scanning fiber-optic two-photon endomicroscopy. IEEE Transactions on Medical Imaging 39(12), 3779-3787 (2020) https://doi.org/10.1109/TMI.2020.3005067
6. Li K*, Liang W*, Yang Z, Liang Y, and Wan S. Robust, accurate depth-resolved attenuation characterization in optical coherence tomography. Biomedical Optics Express 11(2), 672-687 (2020)*Equal contributionhttps://doi.org/10.1364/BOE.382493
7. Voleti V, Patel KB, Li W, Campos CP, Bharadwaj S, Yu H, Ford C, Casper MJ, Yan RW, Liang W, Wen C, Kimura KD, Targoff KL, and Hillman EMC. Real-time volumetric microscopy of in vivo dynamics and large-scale samples with SCAPE 2.0. Nature Methods16(10), 1054–1062 (2019) https://doi.org/10.1038/s41592-019-0579-4
8. Li K, Liang W, Mavadia-Shukla J, Park HC, Li D, Yuan W, Wan S, and Li X. Super-achromatic optical coherence tomography capsule for ultrahigh‐resolution imaging of esophagus. Journal of Biophotonics 12(3), e201800205 (2019) https://doi.org/10.1002/jbio.201800205
9. Liang W*, Hall G*, and Li X. Spectro-temporal dispersion management of femtosecond pulses for fiber-optic two-photon endomicroscopy. Optics Express 26(18), 22877-22893 (2018)*Equal contribution https://doi.org/10.1364/OE.26.022877
10. Liang W, Hall G, Messerschmidt B, Li MJ, and Li X. Nonlinear optical endomicroscopy for label-free functional histology in vivo. Light: Science and Applications 6, e17082 (2017) https://doi.org/10.1038/lsa.2017.82